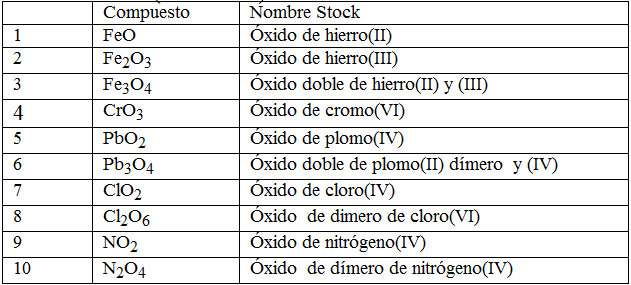
Nomenclatura stock:
La nomenclatura stock consiste en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento. indicando el número de electrones que un átomo pone para que se pueda ceder en un enlace químico. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + de + nombre del elemento específico + el No. de valencia.
Nomenclatura sistemática:
Esta es el primer tipo de nomenclatura que se basa en nombrar los compuestos usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. La forma de nombrar los compuestos en este sistema es: prefijo-nombre genérico + prefijo-nombre específico.

Nomenclatura funcional:
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:
- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” o bien se termina el nombre del elemento con el sufijo –ico.
K
2O, óxido de potasio u óxido potásico
- Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
… -oso cuando el elemento usa la valencia menor: FeO, Fe
+2O
-2, hierro con la valencia 2, (estado de oxidación +2), óxido ferroso
… -ico cuando el elemento usa la valencia mayor: Fe
2O
3, Fe
2+3O
3-2, hierro con valencia 3, (estado de oxidación +3), óxido férrico
3
- Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
hipo- … -oso (para la menor valencia): P
2O, P
2+1O
-2, fósforo con la valencia 1, (estado de oxidación +1), óxido hipofosforoso
… -oso (para la valencia intermedia): P
2O
3, P
2+3O
3-2, fósforo con valencia 3, (estado de oxidación +3), óxido fosforoso
… -ico (para la mayor valencia): P
2O
5, P
2+5O
5-2, fósforo con valencia 5, (estado de oxidación +5), óxido fosfórico
- Cuando tiene cuatro valencias diferentes se usan los prefijos y sufijos
hipo- … -oso (para la valencia más pequeña)
… -oso (para la valencia pequeña)
… -ico (para la valencia grande)
per- … -ico (para la valencia más grande)